首頁 >> 供求商機
無縫克隆試劑盒-單片段
貨號:D0205P
存儲溫度 :-20°C
產品組分
組分/規格 | 50T | 250T |
DNA Assembly Mix Single PLUS | 500μ l | 5 × 500ul |
無縫克隆試劑盒-單片段
產品簡介
基于重組原理的無縫克隆技術,作為新一代的克隆方法,不依賴繁瑣的酶切、連接步驟,也不需要末端補平等操作,依 據 DNA 片段與線性化載體末端的 15~25 nt 同源序列的重組 ,可將插入片段克隆至任意載體的任意位點,載體自連背景 極低 ,是一種簡單、快速、高效的 DNA 定向克隆技術。
DNA Assembly Mix Single Plus 無縫克隆試劑盒,專為單片段優化,最快僅需5 分鐘即可完成單片段 重組 ,且陽性率高于95%。DNA Assembly Mix Single Plus 相較于 DNA Assembly Mix Plus
(Cat:D0204P) ,不依賴連接酶,組分更簡單,對未純化的 PCR 產物兼容性更強。同時,由于不含連接酶,依靠大腸桿菌本身的修復系統,保真度更高。
產品應用
快速克隆;單片段 DNA 組裝;DNA 定點突變。
實驗步驟
1、實驗流程概要
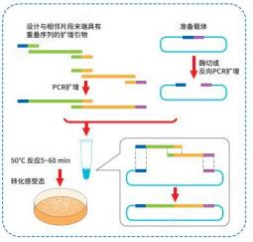
注 1:經雙酶切進行線性化的載體無需去磷酸化,經單酶切則需要去磷酸化;
注 2:酶切完成后,應將快速內切酶失活或對目的產物純化后再用于重組反 應。
注 3 :載體膠回收時建議長時間電泳與殘留的環狀質粒區分開后再切膠, 以減少假陽性率。
2. 線性化克隆載體制備
選擇合適的克隆位點,對載體進行線性化,載體的線性化可以通過酶切或反向PCR擴增完成。
① 酶切制備
推薦使用 LabFD™快速內切酶進行雙酶切 ,使載體線性化wan全,以降低轉化背景(假陽性克隆);若使用單酶切進行線性化,可以適當延長酶切時間以減少環狀質粒殘留。
② 反向 PCR 擴增制備
為減少擴增突變的引入,推薦使用高保真 PCR Mix 進行擴 增。推薦使用預線性化質粒作為模板 ,以減少環狀質粒模板殘 留對克隆陽性率的影響。
注 1 : PCR 產物無非特異性條帶時 ,推薦使用 LabFD™ DpnI ( 貨號 : F5585S) 1 μl 加入 50 μl PCR 產物中 37℃ 1 h ,80℃ 20 min 消化 質粒模板即可用于重組反應;反之建議將 PCR 產物膠回收后使用。
3. 插入片段 PCR 引物設計
PCR 引物的 5' 端必須包含與其相鄰片段(插入片段或載 體)末端同源的 15~25 nt(推薦 18nt)序列。假如載體為粘 性末端 ,且 3'端突出 ,則引物設計必須包含突出部分;若 5'端 突出 ,則引物設計可以包含突出部分 ,也可以不包含。
插入片段正向擴增引物:
5'—上游載體末端同源序列+酶切位點(可選) + 基因特
異性正向擴增序列—3' 插入片段反向擴增引物:
3'—基因特異性反向擴增序列+酶切位點(可選)+下游載 體末端同源序列—5'
注 1:盡量選擇無重復序列且 GC 含量均勻的區域進行克隆 ,當載體克隆位 點上下游 25 nt 區域內 GC 含量為 40% ~60%時 ,重組效lv最高;
注 2 :包含多個重復序列的片段無法采用無縫克隆的策略進行連接。
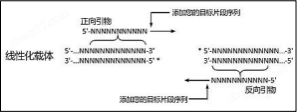
注 3 :包含多個重復序列的片段無法采用無縫克隆的策略進行連接。
4. 插入片段的 PCR 擴增
推薦使用高保真 PCR Mix( Cat:T1211)進行擴增 ,以減少擴增突變的引入。建議使用純化后的 PCR 產物進行無縫克 隆反應,若 PCR 產物經瓊脂糖凝膠電泳鑒定為特異性擴增產物, 可直接使用 ,但加樣體積不應超過總反應體積的 20%。
5. 重組反應
① 于冰水浴中配置以下反應體系:
組分 | 反應體系 | 陰性對照 c |
DNA Assembly Mix Single Plus | 10 μ l | 10 μ l |
線性化載體 a | 50 ~200 ng | 50 ~100 ng |
插入片段 b | 10 ~200 ng | - |
ddH2O | To 20 μ l | |
a.最適載體用量(ng) =0.02×載體堿基對數 ,即 0.03 pmol。
b.插入單片段 ,最適片段用量( ng) = 0.04×片段堿基對數。
c.陰性對照可用來確認線性化載體中是否有環狀質粒殘留 ,推 薦進行。
注 1 :若插入單片段長度大于載體 ,則應互換載體與插入片段用量;
注 2 :若插入片段長度小于 200 bp ,則插入片段應使用 5 倍載體用量;
注 3:若按上述公式計算得到的用量超過最di/最高值,則建議直接按最di/ 最高用量使用;
注 4 :載體片段過長、插入片段過長或片段數過多 ,克隆菌落數和陽性率 均會降低。
注 5 :單點突變按照最適載體用量加入體系。
重組反應體系配制完成后 ,用移液槍輕輕吸打混勻各組 分 ,避免產生氣泡 ,切勿渦旋。
② 將反應體系置于 50℃ , 反應 5~15min。
注 1 :推薦使用 PCR 儀等溫控比較精準的儀器進行反應 ,反應時間不足 克隆效率均會降低;
注 2 : 50℃反應完成后 ,建議進行瞬時離心 ,將反應液收集至管底。
③ 將反應液離心管置于冰上冷卻 ,之后進行轉化或者儲存于-20℃。
注 1 :-20℃儲存的重組產物 ,建議在 1 周內使用。
6. 重組產物轉化
取 10μ l 反應液,加入到 100μ l 感受態細胞中,緩慢吸打混勻,冰上放置 30 min。42℃熱激 60 s,冰浴 5 min。加 500μl SOC 或 LB 培養基 ,37℃振蕩培養 50~60 min(200 rpm)。將菌液均勻涂布在含有對應抗生素的平板上,倒置于 37℃過夜培養。
注 1 :不同感受態細胞最后的克隆陽性率會有所差別 ,推薦使用轉化效 率 >108 CFU/μg 的感受態細胞;
注 2 :菌落數取決于 PCR 產物與線性化載體的數量和純度;
7. 陽性克隆檢測
挑取單菌落至 10μ l ddH2O 中混勻 ,95℃裂解 10 min 后,取 1μ l 裂解液作為模板,進行菌落 PCR 鑒定(Cat:T0214), 或將單菌落接種至抗性培養基中培養過夜后,提取質粒進行 酶切鑒定。
注 1 :菌落 PCR 時建議至少使用一條通用引物 ,避免假陽性結果;
注 2 :必要時可進一步對陽性結果進行測序鑒定。