內(nèi)皮細(xì)胞中的 Rap1 可限制炎癥信號傳導(dǎo),從而抑制動脈粥樣硬化的進(jìn)展
Endothelial Rap1 restricts inflammatory signaling to protect from the progression of atherosclerosis.
Keywords: Cardiovascular disease, Endothelial function, Hemodynamics, Inflammatory signaling, Small GTPase Rap1
動脈粥樣硬化作為血管慢性炎癥疾病,其病理血管壁重塑源于內(nèi)皮損傷引發(fā)的慢性炎癥,且內(nèi)皮對血流模式的差異反應(yīng)決定了斑塊的幾何定位。內(nèi)皮連接機(jī)械傳感復(fù)合物中的 Rap1 是內(nèi)皮機(jī)械傳感反應(yīng)的關(guān)鍵成分,其缺失會損害 NO 釋放和內(nèi)皮功能。Rap1 的兩種亞型 Rap1A 和 Rap1B 在調(diào)節(jié)整合素和鈣黏蛋白等方面發(fā)揮重要作用,對血管穩(wěn)定、生成及內(nèi)皮屏障調(diào)節(jié)很重要。分子層面,Rap1 通過調(diào)控 VEGFR2 信號等影響內(nèi)皮功能。基于此,威斯康星州 Versiti 血液研究所的研究團(tuán)隊(duì)對高膽固醇血癥小鼠模型中內(nèi)皮 Rap1B 缺失的影響進(jìn)行了研究,結(jié)果發(fā)現(xiàn)其雖不增加血管通透性,卻能增強(qiáng)細(xì)胞因子受體信號和 NF-κB 激活,揭示了 Rap1 通過限制促炎細(xì)胞因子信號維持內(nèi)皮穩(wěn)態(tài)的新機(jī)制。研究成果發(fā)表在Arterioscler Thromb Vasc Bio期刊題為“Endothelial Rap1 restricts inflammatory signaling to protect from the progression of atherosclerosis”。

首先,為了研究內(nèi)皮細(xì)胞中 Rap1B缺失對載脂蛋白 E 缺陷(ApoE?/?)小鼠動脈粥樣硬化進(jìn)展的影響,研究將Rap1iΔEC小鼠和對照小鼠分別與ApoE?/?小鼠雜交,生成Athero-Rap1BiΔEC和Athero-對照小鼠,喂食高脂肪西式飲食(HFD,21.2% 脂肪,0.2% 膽固醇 )16周誘導(dǎo)高膽固醇血癥。結(jié)果發(fā)現(xiàn),與正常實(shí)驗(yàn)室飲食喂養(yǎng)的對照小鼠相比,Athero - 對照小鼠的血清膽固醇升高約 3 倍(圖 1A)。Athero-Rap1BiΔEC 小鼠的血清膽固醇也升高,但 Athero-Rap1BiΔEC 與 Athero - 對照小鼠的總膽固醇水平無差異(圖 1A)。在 HFD 處理結(jié)束時,用油紅 O 染色觀察動脈粥樣硬化病變,并在雄性和雌性小鼠的主動脈正面切片中量化斑塊面積(圖 1B)。Athero-Rap1BiΔEC 的動脈粥樣硬化病變面積顯著增加 ,且雌性小鼠病變更明顯(圖 1C )。由于基礎(chǔ)內(nèi)皮NO合成對預(yù)防動脈粥樣硬化進(jìn)展至關(guān)重要,研究進(jìn)一步給小鼠補(bǔ)充L-精氨酸,發(fā)現(xiàn)其能減少Athero-Rap1BiΔEC小鼠的斑塊形成(圖 1C )。而在細(xì)胞實(shí)驗(yàn)中,L-精氨酸處理雖能增加對照和siRap1B人主動脈內(nèi)皮細(xì)胞的NO釋放,但siRap1B細(xì)胞的NO釋放量更低(圖 1D),且Rap1B缺陷會增加細(xì)胞對NO抑制劑的敏感性(圖 1E)。這些數(shù)據(jù)表明,NO生成缺陷是Athero-Rap1BiΔEC小鼠動脈粥樣硬化增強(qiáng)的潛在因素,證實(shí)了Rap1B在體內(nèi)對動脈粥樣硬化進(jìn)展的保護(hù)作用。
接下來,為了探究 Rap1 如何影響血流模式剪切應(yīng)力相關(guān)的病理變化,研究人員對降主動脈(層流區(qū)域)和主動脈弓(紊亂血流區(qū)域)的斑塊進(jìn)行量化分析。結(jié)果顯示,高脂飲食 16 周后,主動脈弓的動脈粥樣硬化斑塊積聚在升主動脈(AA)和降主動脈(DA)內(nèi)曲率的 5 個區(qū)域,以及頭臂動脈(BCA)、左頸總動脈(LCC)和左鎖骨下動脈(LS)分支分叉的對側(cè)表面(圖 1F)。 與 Athero - 對照小鼠相比, Athero-Rap1BiΔEC 小鼠降主動脈(層流區(qū))的病變面積顯著增加,而補(bǔ)充 L - 精氨酸可使其斑塊面積降至對照水平(圖 1G )。在紊亂血流的主動脈弓區(qū)域,兩者斑塊面積無顯著差異,但 Athero-Rap1BiΔEC 小鼠在層流和紊亂流區(qū)域的平均斑塊體積均顯著增加(圖 1H) 。進(jìn)一步研究發(fā)現(xiàn),Athero-Rap1BiΔEC 小鼠主動脈根部的巨噬細(xì)胞密度顯著升高(圖 1J) ,表明炎癥反應(yīng)增強(qiáng)。這些結(jié)果表明,內(nèi)皮 Rap1B 通過不同機(jī)制在層流和紊亂血流區(qū)域發(fā)揮抗動脈粥樣硬化作用。

圖1 無論是否存在層流,內(nèi)皮 Rap1B 缺失均會加劇動脈粥樣硬化斑塊沉積。
為了驗(yàn)證 Rap1 缺失的內(nèi)皮細(xì)胞中炎癥性 CAM 表達(dá)升高可能與白細(xì)胞募集增加相關(guān)假設(shè),研究人員對 Athero - 對照和 Athero-Rap1iΔEC 小鼠主動脈弓切片進(jìn)行熒光染色,原位檢測炎癥性 CAM 的表達(dá)(圖 2A,B)。結(jié)果發(fā)現(xiàn) Athero-Rap1iΔEC 小鼠主動脈弓中 VCAM1 和 ICAM1 的表達(dá)較對照小鼠顯著增加(圖 2C,D),而基礎(chǔ)條件下 EC-Rap1 缺失并未引起 CAM 表達(dá)增加,Rap1iΔEC 和對照小鼠的 VCAM1 水平相似,且兩種小鼠中均未檢測到 ICAM1。此外,在細(xì)胞實(shí)驗(yàn)中,TNF-α 處理 48 小時后,Rap1 缺失的 hAECs 中 VCAM1 表達(dá)明顯升高(圖 2E,F)。這些結(jié)果表明,內(nèi)皮 Rap1 缺失會增強(qiáng)血管內(nèi)皮對 TNF-α 的致動脈粥樣硬化反應(yīng),在促炎信號誘導(dǎo)的內(nèi)皮 CAM 表達(dá)中發(fā)揮關(guān)鍵作用。TNF-α 除了通過誘導(dǎo)促炎轉(zhuǎn)錄發(fā)揮致動脈粥樣硬化作用外,還能通過引起血管屏障功能障礙的非轉(zhuǎn)錄機(jī)制發(fā)揮作用。為了探究體內(nèi) Rap1 缺失的內(nèi)皮細(xì)胞屏障通透性增加的生理意義,研究人員檢測了 Athero - 對照和 Athero-Rap1BiΔEC 小鼠主動脈根部中BSA的外滲情況,發(fā)現(xiàn)在動脈粥樣硬化條件下兩者血管通透性無差異,脂多糖處理誘導(dǎo)急性炎癥時結(jié)果也相似。這些結(jié)果表明,Rap1 缺失會增加細(xì)胞黏附分子的轉(zhuǎn)錄,但不會增加血管通透性。

圖2 在缺乏層流的情況下,內(nèi)皮細(xì)胞 Rap1 缺失會升高炎癥受體(CAM)的表達(dá)。
接著,研究人員檢測了主動脈弓中 NF-κB 的激活情況(圖 3A)。結(jié)果發(fā)現(xiàn) Athero-Rap1iΔEC 小鼠主動脈弓內(nèi)皮細(xì)胞中 NF-κB 的 p65 亞基核定位較 Athero - 對照小鼠顯著增加(圖 3B),表明其血管中 NF-κB 激活增強(qiáng)。在紊亂血流區(qū)域,NF-κB 和促炎蛋白轉(zhuǎn)錄的增加由 TNF-α 受體 TNFR1 介導(dǎo),而 Athero-Rap1iΔEC 主動脈中 CAM 表達(dá)升高(圖 2C,D) 和 NF-κB 激活(圖 3B) 提示 Rap1 可能調(diào)控 TNF-α 誘導(dǎo)的激活過程。為了驗(yàn)證這一假設(shè),研究人員通過在缺乏層流的條件下研究了 TNF-α 對內(nèi)皮細(xì)胞中 NF-κB 激活早期信號事件的影響 。在此條件下,TNF-α 刺激 hAECs 可導(dǎo)致 IκB 激酶(IKK)快速磷酸化,其下游的 IκB 在 Ser32/36 位點(diǎn)磷酸化,隨后 IκB 降解(圖 3C)。當(dāng) hAECs 缺失 Rap1 時,TNF-α 誘導(dǎo)的 IκB 磷酸化在刺激后2 分鐘即迅速升高(圖 3D)。 因此,siRap1 hAECs 中總 IκB 的變化呈瞬時性,與磷酸化依賴的 IκB 降解加速一致(圖 3C)。 與 Rap1 缺失下 IκB 磷酸化增強(qiáng)一致,TNF-α 誘導(dǎo)的 IKK 磷酸化在 Rap1 缺失的 hAECs 中較野生型對照顯著升高(圖 3D)。 綜上,Rap1 缺失可顯著增強(qiáng) IKK 激活,加速 NF-κB 激活的早期信號事件。

圖3 在缺乏層流的情況下,Rap1 缺失會導(dǎo)致 NF-κB 激活增加。
TNFR 復(fù)合體的信號傳導(dǎo)可通過募集 PI3K 及其靶標(biāo) Akt 來增強(qiáng),作為 TNFR 復(fù)合體的一部分,Akt 可磷酸化 IκB 和 IKK 以誘導(dǎo) NF-κB 活性。先前研究表明 Rap1 參與上游 Akt 激活因子 PI3K 的調(diào)控,其可通過效應(yīng)結(jié)構(gòu)域與 PI3K 相互作用,通過構(gòu)象改變和 PI3K 重定位促進(jìn) PI3K 激活。基于此,研究假設(shè) Rap1 缺失時 PI3K-Akt 相互作用可能被干擾,導(dǎo)致 NF-κB 激活增加。
為了驗(yàn)證上述假設(shè),研究人員在 Rap1 缺陷和對照 ECs 中,使用 Akt1/2 選擇性抑制劑 AKT inhibitor VIII 處理后檢測 TNF-α 誘導(dǎo)的 IKK 和 IκB 磷酸化(圖 4A)。結(jié)果顯示 TNF-α 處理未導(dǎo)致 Akt 磷酸化升高,而 AKT inhibitor VIII 處理使 WT 和 siRap1 ECs 中 Akt-Ser473 磷酸化顯著降低(圖 4B),且該抑制劑不改變 WT hAECs 中 IκB 或 IKK 的磷酸化,卻能降低 siRap1 hAECs 中 TNF-α 誘導(dǎo)的過度 IκB 和 IKK 磷酸化至 WT 水平(圖 4C,D)。這些結(jié)果表明,限制 Rap1 缺陷細(xì)胞中的 Akt 活性可恢復(fù) ECs 對 TNF-α 的正常反應(yīng),提示 Rap1 通過限制 Akt 介導(dǎo)的 IKK 激活來抑制 TNF-α 誘導(dǎo)的 NF-κB 激活信號。

圖4 在缺乏層流的情況下,Rap1 通過抑制 Akt 來限制向 NF-κB 的炎癥信號傳導(dǎo)。
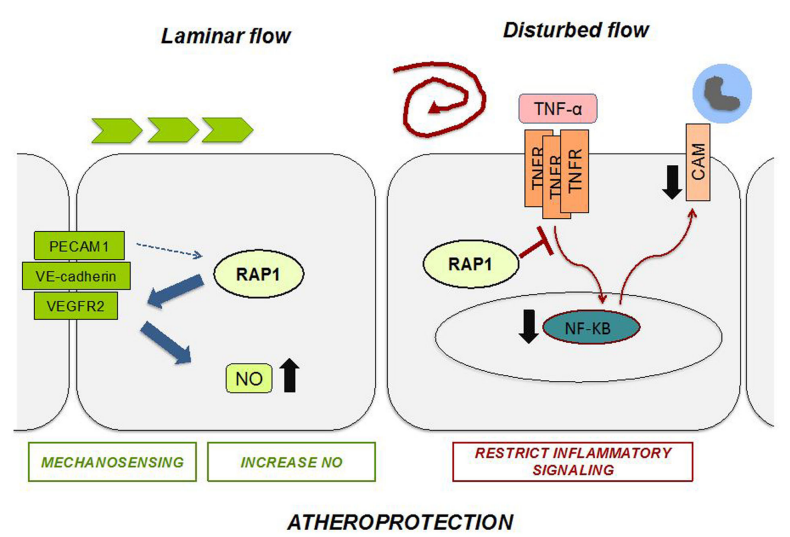
圖5 內(nèi)皮 Rap1 通過不同的機(jī)制在存在和缺乏層流的情況下預(yù)防動脈粥樣硬化。
總之,該研究確定了 EC 穩(wěn)態(tài)的新機(jī)制,內(nèi)皮 Rap1 在存在和缺乏層流的情況下均可抑制動脈粥樣硬化進(jìn)展:在層流中,Rap1 刺激 NO 釋放起主要作用;在缺乏層流時,限制促炎信號傳導(dǎo)起主要作用。Rap1 抗動脈粥樣硬化功能(圖5)為內(nèi)皮穩(wěn)態(tài)和 CVD 進(jìn)展的機(jī)制提供了新的見解。
參考文獻(xiàn):Singh B, Kosuru R, Lakshmikanthan S, Sorci-Thomas MG, Zhang DX, Sparapani R, Vasquez-Vivar J, Chrzanowska M. Endothelial Rap1 (Ras-Association Proximate 1) Restricts Inflammatory Signaling to Protect From the Progression of Atherosclerosis. Arterioscler Thromb Vasc Biol. 2021 Feb;41(2):638-650. doi: 10.1161/ATVBAHA.120.315401. Epub 2020 Dec 3. PMID: 33267664; PMCID: PMC8105264.
圖片來源:所有圖片均來源于參考文獻(xiàn)
小編旨在分享、學(xué)習(xí)、交流生物科學(xué)等領(lǐng)域的研究進(jìn)展。如有侵權(quán)或引文不當(dāng)請聯(lián)系小編修正。如有任何的想法以及建議,歡迎聯(lián)系小編。感謝各位的瀏覽以及關(guān)注!關(guān)注“Naturethink”公眾號,了解更多相關(guān)內(nèi)容。
相關(guān)產(chǎn)品
免責(zé)聲明
- 凡本網(wǎng)注明“來源:化工儀器網(wǎng)”的所有作品,均為浙江興旺寶明通網(wǎng)絡(luò)有限公司-化工儀器網(wǎng)合法擁有版權(quán)或有權(quán)使用的作品,未經(jīng)本網(wǎng)授權(quán)不得轉(zhuǎn)載、摘編或利用其它方式使用上述作品。已經(jīng)本網(wǎng)授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:化工儀器網(wǎng)”。違反上述聲明者,本網(wǎng)將追究其相關(guān)法律責(zé)任。
- 本網(wǎng)轉(zhuǎn)載并注明自其他來源(非化工儀器網(wǎng))的作品,目的在于傳遞更多信息,并不代表本網(wǎng)贊同其觀點(diǎn)和對其真實(shí)性負(fù)責(zé),不承擔(dān)此類作品侵權(quán)行為的直接責(zé)任及連帶責(zé)任。其他媒體、網(wǎng)站或個人從本網(wǎng)轉(zhuǎn)載時,必須保留本網(wǎng)注明的作品第一來源,并自負(fù)版權(quán)等法律責(zé)任。
- 如涉及作品內(nèi)容、版權(quán)等問題,請在作品發(fā)表之日起一周內(nèi)與本網(wǎng)聯(lián)系,否則視為放棄相關(guān)權(quán)利。
 手機(jī)版
手機(jī)版 化工儀器網(wǎng)手機(jī)版
化工儀器網(wǎng)手機(jī)版
 化工儀器網(wǎng)小程序
化工儀器網(wǎng)小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關(guān)注視頻號
掃碼關(guān)注視頻號



















 采購中心
采購中心